Лекция 2. Физико-химические свойства воды.
Вода как физико-химическое тело оказывает непрерывное влияние на жизнь гидробионтов. Она представляет организмам опору, приносит им пищу и кислород, уносит продукты метаболизма, переносит половые продукты. Благодаря (подвижности воды в гидросфере возможно существование прикрепленных животных, которых, как известно, нет на суше, и осуществляется пассивное расселение гидробионтов. Поэтому физико-химические свойства воды представляют собой один из важнейших факторов абиотической среды для обитателей пелагиали (плавающих в толще воды) и бентали (живущих на грунте или в нем). Для бентосных организмов первостепенное значение приобретают физико-химические особенности населяемого ими грунта.
Химический состав и строение воды. Молекула воды состоит из двух атомов водорода и одного атома кислорода, но так как первые имеют 3 изотопные формы, а вторые — 6, то существует 36 разновидностей воды, из которых в природе встречаются 9. Основную массу природной воды образуют молекулы Н2О(16) (99,73 мольных %), в значительно меньшем количестве (0,20 мольных %) встречаются молекулы Н2О(18) и еще реже (0,07 мольных %) те, в состав которых входят дейтерий, тритий и тяжелые изотопы кислорода. По своим свойствам тяжелая вода (с молекулярным весом более 18) заметно отличается от обычной. Так, вода содержащая дейтерий, плотнее обычной на 10,8%, замерзает при 3,3°С, кипит при 101,4° С, имеет значительно большую (на 23%) вязкость.
Молекула воды имеет два отрицательных и два положительных заряда, расположенных по вершинам тетраэдра таким образом, что первые оказываются на одном полюсе, а вторые — на другом. Таким расположением зарядов определяется дипольный характер воды с хорошо выраженной поляризованностью молекул. Благодаря этой особенности растворенные в воде электролиты легко диссоциируют на ионы в результате их 'притягивания своеобразными электромагнитами — дипольными молекулами воды. С помощью водородных связей, образующихся между атомами кислорода и водорода смежных молекул, возникают агрегаты последних, повышающие структурную упорядоченность воды и заметно меняющие ее свойства. Так, во время замерзания воды каждая из молекул за счет образования водородных связей соединяется с четырьмя другими, и возникает характерная для льда структура с относительна рыхлой «упаковкой» молекул. Этим объясняется снижение удельного веса воды после замерзания. С повышением температуры структура воды постепенно разрушается. Молекулы воды и их обломки могут сближаться, заполнять свободные пространства и благодаря этому увеличивать плотность жидкости. При дальнейшем нагревании структура воды разрушается полностью,, молекулы располагаются рыхло, и удельный вес жидкости снижается.
Есть данные о том, что специфические функции в живом органе вода может выполнять только в структурированном состоянии, которое полностью исчезает после нагревания до 40° С. Именно такая температура является летальной для многих живых организмов. С другой стороны, есть ряд наблюдений о стимулирующем действии талой воды на гидробионтов, которая отличается наибольшей структурированностью.
Термические и оптические свойства воды. По сравнению с почвой и воздухом вода отличается гораздо большей термостабильностью, что благоприятно для существования жизни. Сохранению температурного постоянства воды способствует ее высокая теплоемкость, равная 1 кал/г. По этой причине даже значительные поступления или потери тепла не ведут к резким изменениям температуры воды и, например, максимальные колебания ее в Мировом океане не превышают 30—40° С, в то время как в почве и воздухе они могут достигать 120—140° С. Повышению термостабильности воды в естественных условиях способствует ее аномальное свойство уменьшать свою плотность с понижением температуры от 4 до 0° С. Расширяясь при замерзании, вода превращается в лед, который, будучи более легким, чем вода, плавает на ее поверхности и образует теплоизоляционный слой, предупреждающий промерзание водоемов. Таким образом, находясь в воде, гидробионты обычна застрахованы от замерзания, которое часто вызывает гибель наземных организмов.
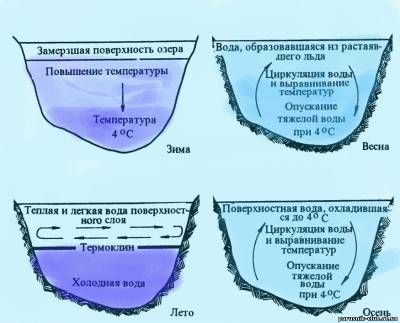
Поддержанию термостабильности воды способствует ее крайне высокая теплота парообразования (539 кал/г) и плавления (80 кал/г). Когда вода подвергается нагреванию, испарение возрастает и за счет этого повышение температуры задерживается. Количество тепла, отдаваемого гидросферой за год, вследствие испарения (около 2 х 10 в 19 степени кал) примерно в 400 раз превышает всю ту техническую энергию, которую люди вырабатывают на Земле за такое же время (5 • 10 в 16 степени кал). Когда вода охлаждается ниже 0° С, образуется лед с выделением большого количества тепла, что препятствует резкому понижению температуры. Вода обладает сравнительно низкой теплопроводностью, что сильно ограничивает распространение температурных изменений возникших на одном участке, в другие зоны водоема. Появляющаяся слоистость, или температурная стратификация, предупреждает, например, прогревание до дна даже сравнительно мелких водоемов в жаркое время года. Образованию температурной стратификации способствует также свойство воды уменьшать свою плотность с понижением температуры от 4 до 0° С. Зимой подледные холодные воды не погружаются вглубь, плавая на более теплых: летом прогретые воды не опускаются ко дну, где находятся более холодные и потому более плотные воды. Таким образом, аномальные свойства воды существенно тормозят выравнивание температурных градиентов.
Плотность природных вод. Удельный вес природной воды в первую очередь определяется количеством растворенных в ней веществ и температурой. С увеличением содержания солей в воде ее удельный вес может достигать 1,347 г\см3. Зависимость плотности воды от температуры носит следующий характер:
Температура, °С . . . . 0 4 10 20 30
Плотность, г/см3 . . ... 0,99986 1,00000 0,99972 0,99823 0,99567
Как правило, при уменьшении температуры плотность увеличивается, хотя встречаются вещества, чья плотность ведёт себя иначе, например, вода, бронза и чугун. Так, плотность воды имеет максимальное значение при 4 °C и уменьшается как с повышением, так и с понижением температуры относительно числа при 4 °C.
На первый взгляд, изменения плотности воды с повышением температуры не так существенны. Однако следует учесть, что удельный вес гидробионтов обычно отличается от единицы лишь во втором или даже третьем знаке. Поэтому температурные колебания плотности воды в пределах третьего и четвертого знака означают очень многое в жизни пелагических организмов в смысле изменения условий плавания (различная опорность среды). Кроме того важное значение для гидробионтов имеет стратификация воды (или ее перемешивание по вертикали), связанное с аномальными свойствами изменения плотности воды в зависимости от температуры.
Другое значение плотности воды как экологического фактора связано с ее давлением на организм, которое на глубинах, измеряемых километрами, выражается сотнями атмосфер. С углублением на 10,3 м в пресную и на 9,986 м в морскую воду (при 4° С) давление возрастает на 1 атм и в океанических глубинах может достигать свыше 1000 атм. Организмы, способные существовать в широком диапазоне давлений воды, называются эврибионтными, а не выдерживающие больших колебаний этого фактора — стенобиотными. Например, некоторые виды голотурий встречаются на глубинах от 100 до 9000 м, черви — в литорали и на глубине до 7 тыс. м. По-видимому, недостаточная толерантность (терпимость) к повышенному давлению мешает пузырным сифонофорам заселять большие глубины, в то время как беспузырные могут проникать в абиссаль и ультраабиссаль (М. Е. Виноградов, 1968). Распределение гидробионтов по разным глубинам связано не только с давлением воды, но и с многими другими факторами.
В условиях опыта гидробионты проявляют высокую устойчивость к повышению давления. Крабы некоторых видов без вреда для себя выносили погружение на 900 м, моллюски — на 2227 м. Бактерии выдерживают гидростатическое давление до 1000 атм, коловратки — до 1600 атм. Рачки циклопы начинают проявлять беспокойство только после повышения давления до 100 атм; при 400 атм. они теряют активность и падают на дно. У различных инфузорий и жгутиковых снижение двигательной активности наблюдается с повышением давления до 260—950 атм. Через 5—6 ч после снятия давления в 1000 атм. возвращались к нормальной жизни актинии, через 10—12 ч — морские звезды.
У многих гидробионтов, в частности у личинок ракообразных, головоногих, двустворчатых моллюсков и гребневиков, повышение давления вызывает движение вверх и положительный фототаксис, а снижение — обратную реакцию; очевидно, давление — важный фактор, определяющий характер распределения жизни в толще воды. Интересно, что личинки реагируют на повышение давления всплыванием, а на более поздних стадиях эта реакция исчезает; такая смена реакций способствует расселению личинок на ранних стадиях и оседанию на более тхоздних. Установлено» что сжимаемость некоторых равноногих рачков и эвфаузиид на 15—40% ниже, чем воды. С погружением вглубь плотность животных все более приближается к таковой воды, и они всегда могут найти такую глубину, где будут обладать устойчивой нейтральной плавучестью. В качестве одного из примеров своеобразного влияния высокого давления можно привести вызываемый им сдвиг в соотношении полов у морских некоторых гарпактицид. Науплиусы этого рачка, подвергнутые давлению 450—700 атм, превращались только в самок, хотя в контрольной группе (давление 1 атм) преобладали самцы (84%); очевидно, высокое давление разрушала биохимическую систему, определяющую появление самцов.
Органами восприятия гидростатического давления служат различные газовые 'камеры (плавательные пузыри рыб, газовые включения в цитоплазме простейших, воздухоносные полости в подошве некоторых медуз, в раковинах головоногих и брюхоногих моллюсков и др.). Изменение давления газа в камерах, воспринимаемое различными рецепторами, указывает глубину погружения организма. Точность определения глубины у некоторых гидробионтов может достигать нескольких сантиметров.
Вязкость воды. Под вязкостью понимается свойство тел оказывать сопротивление сдвигу их слоев относительно друг друга. Это сопротивление, возникающее при относительном движении двух смежных слоев, пропорционально их площади и градиенту скорости вдоль оси, перпендикулярной к направлению движения. Единицей вязкости является пуаз (пз). Пуаз — это такая вязкость, при которой градиент скорости, равный 1 см/сек на 1 см расстояния между слоями жидкости, приводит к возникновению силы внутреннего трения в 1 дину 10-5 ньютонов) на 1 см2 поверхности касания слоев. Обычно вязкость воды обозначается в сотых долях пуаза — санти-пуазах (спз). По сравнению с другими жидкостями вода обладает сравнительно малой вязкостью. Так, для воды с температурой 10 °С вязкость равна 1,31 спз, а для глицерина в тех же условиях — 3950 спз. Малая вязкость воды облегчает организмам плавание, поскольку на преодоление внутреннего трения приводимых в движение слоев воды затрачивается сравнительно небольшая сила. Повышение температуры сопровождается понижением вязкости воды:
Температура, °С................ 10 20 30
Вязкость, спз...................... 1,3 1 1,1 0,87
С увеличением солености вязкость воды несколько возрастает. Изменение вязкости особенно сильно влияет на условия передвижения мелких организмов. С одной стороны, они обладают сравнительно маломощной локомоторной системой, в то время как относительная поверхность, пропорционально которой действуют силы трения, очень велика. С другой стороны, вязкость тормозит движение тем больше, чем ближе находятся смещаемые относительно друг друга слои воды. Для мелких организмов они располагаются на очень небольших расстояниях и потому преодоление сил трения требует значительных энергетических затрат. Изменение вязкости с повышением температуры и солености воды имеет весьма существенное значение в жизни водного населения, особенно для его мелких представителей, существенно влияя на скорость их передвижения. Огромное влияние вязкость воды оказывает на скорость погружения организмов. При отсутствии трения гидробионты, не обладающие локомоторной системой, лишились бы способности удерживаться в толще воды, а подвижным формам пришлось бы тратить много дополнительной энергии, чтобы избегать погружения на дно. Вязкость воды облегчает организмам парение в ее толще, поэтому у многих гидробионтов выработались специальные адаптации, направленные на увеличение сил трения с водой, особенно в летнее время, когда ее вязкость в связи с повышением температуры снижается.
Движение воды. Перемещения водных масс вызываются гравитационными силами, ветровыми воздействиями, организмами и некоторыми другими причинами. К гравитационным силам, вызывающим движение воды, относится притяжение Луны и Солнца, обусловливающее чередование приливов и отливов. Силы земного тяготения вызывают течение рек, т. е. перемещение в них воды с высоких уровней на более низкие, а также перемещения водных масс с разной плотностью в морях и озерах. Ветровые воздействия за счет сил трения вопреки гравитационным градиентам перемещают поверхностные воды и вызывают ряд сопряженных с этим перемещением компенсационных течений. Организмы перемешивают воду своими передвижениями и во время пропускания ее через специальные структуры своего тела при фильтрации.
Движение воды проявляется «в форме течений и волнений. В первом случае происходит перенос водных масс в определенном направлении, во втором — уклонение частиц воды от исходного положения с последующим возвратом к нему. Течения бывают горизонтальными и вертикальными, поверхностными и глубинными. Возникновение под действием внешних сил того или иного течения неизменно сопровождается образованием противоположно направленного компенсационного перемещения воды.
Движение воды имеет для гидробионтов прямое и косвенное значение. В первом случае речь идет о переносе пелагических организмов в горизонтальном направлении, перемещении их по вертикали и вымывании бентосных форм из грунта, часто сопровождающимся их сносом токами воды, как, например, это наблюдается в ручьях и реках. Косвенное влияние движения воды на гидробионтов сказывается ввиду того, что она приносит пищу и кислорода, унос метаболитов, выравнивание температурных и других гидрологических градиентов, а также через воздействие на формирование грунтов. В областях сильных придонных течений грунты более подвижны, содержат меньше тонких фракций, подвержены взмучиваниям и накопления донных осадков здесь не происходит. Там, где течения слабы или их нет, донные осадки накапливаются, грунты становятся стабильнее, содержат много тонких фракций. Волны, которые в основном вызываются взаимодействием водных и воздушных масс, особенно большое значение имеют для обитателей прибрежий, где прибой перетирает грунт, перемещает его по вертикали и горизонтали, уносит с одних мест и откладывает в других. Некоторое представление о силе прибоя и его значении для гидробионтов может дать тот факт, что у скалистых берегов вода иногда взлетает на высоту до 100—150 м. Жизнь в зоне прибоя крайне обедняется, и здесь существуют лишь немногие формы, приспособившиеся к ударам волн.
Для восприятия движений воды у гидробионтов существуют самые различные рецепторы. Рыбы оценивают скорость и направление течения с помощью органов боковой линии, ракообразные — антеннами, моллюски — рецепторами в выростах мантии. У очень многих беспозвоночных имеются виброрецепторы, воспринимающие колебания воды. У гребневиков они обнаружены в эпителии, у гидромедуз — по краям манубриума, у раков представлены вееровидными органами, сидящими в углублениях на поверхности тела, личинки насекомых воспринимают вибрацию воды различными волосками и щетинками. Хетогнаты охотятся за добычей исключительно с помощью виброрецепторов, причем хватательная реакция возникает только на вибрации малой интенсивности.
Водородный показатель воды рН.
Водоро́дный показа́тель, pH (лат. pondus Hydrogenii - сила водорода, произносится «пэ аш», английское произношение — piː'eɪtʃ) — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр.
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
Так как в кислых растворах [H+] > 10−7, то у кислых растворов pH < 7, аналогично, у щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
В человеческом организме в различных органах водородный показатель различен. Так в желудочно-кишечном тракте человека pH изменяется от кислотного в желудке (pH 1,5—2,0) до щелочного в толстой кишке (pH 8,5—9,0).
Вода, имеющая рН от 0 до 4 - сильно кислая.
Вода, имеющая рН от 4 до 5,5 - кислая.
Вода, имеющая рН от 5,5 до 7 - слабо кислая.
Вода, имеющая рН 7 - нейтральная.
Вода, имеющая рН от 7 до 8,5 - слабо щелочная.
Вода, имеющая рН от 8,5 до 10 - щелочная.
Вода, имеющая рН от 10 до 14 - сильно щелочная.
Экология воды.
Вода - универсальный растворитель.
Кластерная структура воды.
Суточная потребность 1,5 и более литров. С возрастом количество воды снижается. При нарушении водного баланса происходит ряд нарушений.
Гигиеническое значение воды.
Суточная потребность воды зависит от региона может достигать до 1000 литров на человека. При отсутствии центрального водоснабжения 60 л.
Классификация загрязнения воды:
1. Болезнетворными организмами.
2. Химическое загрязнение воды
А. Неорганическими
Б. Органическими
В. Токсическими
Г. Поверхностно-активными в-вами
Эпидемиологическое значение воды. Около полумиллиарда человек болеет заболеваниями, передающимися водным путем, 3 миллиона погибает.
1. Бактериальные антропонозы (дизентерия)
2. Вирусные (гепатит, полиомиелит)
3. Зоонозные инфекции.
4. Паразитарные заболевания - заболевания простейшими лямблиоз), гельминтозы (геогельминты)
5. Эндемические заболевания. Связаны с минеральным составом воды.
Возбудитель должен попасть в воду, патогенные микроорганизмы должны сохранять активность в воде, возбудитель должен попасть в организм.
Эпидемиологическая характеристика вспышек заболеваний.
1. Массовость (диффузная) При залповом загрязнении микроорганизм может попасть в водопроводную сеть и вызвать заболевание.
2. Сезонность (ранняя весна)
3. По этиологичности.
4. По клинике полиморфизм (различная по степени тяжести клиническая картина)
5. Снижение степени тяжести заболеваний в динамике.
6. Резкий подъем и медленный спад.
При пищевом: очаговость, резкий подъем и спад, примерно одинаковые клинические проявления.
Химический состав воды.
1. Хим. вещества присутствуют в воде в любом случае
2. Хим. вещества, попадающие в воду вследствии воздействия человека.
Минеральный состав воды.
Низкая концентрация и плохо усваивается.
1. Общая минерализация - соли хлора и серы. Не выше 1 г на литр.
Для питьевой воды не более 1г на литр. Если больше грамма - минеральная вода. Питьевая вода должна быть без вкуса. Минеральная вода - с привкусом.
Нормальная питьевая вода - 200-400мг на литр. В СПб слабоминерализована
Жесткость воды. Постоянная и устранимая жесткость. Устранимая - при кипячении выпадают в осадок (карбонатная жесткость КН). Неустранимая – GH.
При смене жесткости воды могут наблюдаться диспептические расстройства. До 7 мг на литр.
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой. Термин «жёсткая» по отношению к воде исторически сложился из-за свойств тканей после их стирки с использованием мыла на основе жирных кислот — ткань, постиранная в жёсткой воде, более жёсткая на ощупь. Этот феномен объясняется, с одной стороны, сорбцией тканью кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки на макроуровне. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне. Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2), и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний. Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Методы устранения высокой жесткости воды.
Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Полностью очистить воду от солей жёсткости можно дистилляцией.
В воде общая минерализация - в основном это хлориды и сульфаты. Влияют на органолептические свойства.
Азотистые соединения. Определяются в любой воде. Образуются при окислении органических веществ в воде. При кипячении уничтожаются сапрофитные бактерии, что со временем приводит к ухудшению органолептических свойств воды. Аммиак—нитриты—нитраты. По концентрации этих соединений можно говорить об органическом загрязнении воды.
Метгемоглобинемию вызывают нитриты.
Эндемические заболевания.
Флюорорроз.
Проявляетя изменением суставов.
Остеопороз, тугоподвижность суставов.
Эндемический зоб.
Химич. вещества, попадающие в воду вследствие антропогенных факторов, В воде большинства водоемов на сегодня более 3000 хим. веществ.
ПДК - предельно допустимая концентрации.
1. Изучение влияние вещества на органолептические свойства воды.
2. Изучение токсических свойств вещества.
3. Влияние вещества на процессы самоочищения водоемов.
Определяется лимитирующий показатель, на основании которого устанавливается ПДК.
Качество воды оценивали в разные этапы развития наук по разному.
1 этап - органолептические свойства.
2 этап - начало 19 века. В Брюсселе принят документ, нормирующий химический состав воды питьевой.
3 этап - микробиологические показатели.
4 этап - все показатели вместе с середины прошлого века.
Требования к питьевой воде.
1. Должна отвечать безопасности, безвредна и благоприятна.
2. Качество воды должно соответствовать не только на водопроводной станции, но и в местах забора.
3. Безопасность питьевой воды определяется по нормативу, характеризующему микробное, вирусное и паразитарное воздействие.
4. Безвредность определяется по 3 группам показателей
А. Обобщенные показатели хим веществ, содержащиеся в естественных условиях.
Б. Образующиеся в воде при очистке или обеззараживании.
В. Токсические химические вещества.
5. Микробиологические показатели.
Органическое загрязнение воды
Определяется по азотистым соединениям.
Окисляемость воды - то количество кислорода, которое необходимо для окисления органики.
Биохимическая потребность кислорода - то кол-во кислорода, которое необходимо для биохимического окисления воды.
Микробиологические показатели.
Термотолерантные колиформные бактерии. Не должно быть в 300 мл воды.
Общее микробное число не более 50 в 1 мл воды.
Паразитарное загрязнение Ни одной цисты лямблий в 50 литрах воды.
Водородный показатель Нормативы 6-9 рН.

