Лекція 3: Органічні речовини. Білки – структурна основа біосистем.
План.
1. Органічні речовини, їх різноманітність та значення в існуванні живих істот.
2. Білки – структурна основа біосистем.
3. Амінокислотний склад білків.
4. Будова та хімічні властивості амінокислот.
5. Рівні структурної організації білкової молекули.
6. Чинники підтримання та зміни конформації білка. Ф
7. Фізико-хімічні властивості білків.
8. Ферменти. Класифікація ферментів та її принципи. Структурно-функціональна організація ферментів.
9. Властивості ферментів.
Всі органічні сполуки на Землі поділяються на чотири основні групи: білки, ліпіди, вуглеводи і нуклеїнові кислоти. Ліпіди: ефіри жирних кислот і спиртів. Поділяють на дві великі групи: жири і ліпоїди.
Жири або гліцериди—складні ефіри трьохатомного спирту гліцерину та вищих жирних кислот.
Ліпоїди—жироподібні речовини (фосфатиди, стероїди, стеарини, воски.)
Вуглеводи: мають загальну хімічну формулу – (СН2О)n. Розрізняють три основні групи вуглеводів: полісахариди, дисахариди, моносахариди
Нуклеїнові кислоти: ДНК (дезоксирибонуклеїнова кислота), РНК (рибонуклеїнова кислота), АТФ, АДФ та АМФ, НАД (нікотинамідаденіндінуклеотид) та її похідні НАДФ, НАД+Н, НАДФ+Н.
Білки: високомолекулярні біополімери, мономерною одиницею яких є амінокислота.
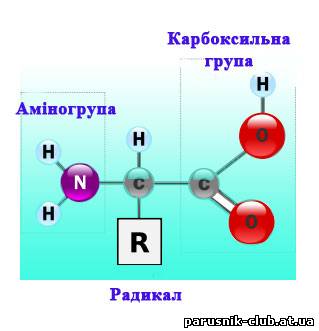
Амінокислоти - органічні (карбонові) кислоти, що містять, як правило, одну або дві аміногрупи (- NH2). Залежно від положення аміногрупи у вуглецевому ланцюзі по відношенню до карбоксилу розрізняють a- b- g-. А. У природі широко розповсюджена формула а - амінокислот. А-А., що мають (окрім гліцину) один або два асиметричних атома вуглецю і, в основному, L-конфігурацію. У побудові молекул білка беруть участь звичайно біля 20 L- А-А. Специфічна послідовність чергування А. у пептидних ланцюгах, визначувана генетичним кодом, обумовлює первинну структуру білка. Вищі рослини і хемосинтезуючі організми всі необхідні їм А. синтезують з амонійних солей і нітратів (у рослин в клітинах вони відновлюються до NН3) і кето- або оксикислот - продуктів дихання і фотосинтезу. Людина і тварини синтезують більшість замінних А. із звичайних безазотистих продуктів обміну і амонійного азоту; незамінні амінокислоти повинні поступати з їжею. Займають центральне місце в обміні азотистих речовин (входять до складу білків, пептидів, беруть участь в біосинтезі пуринів, пірімідінів, вітамінів, медіаторів алкалоїдів і ін. сполук). У організмі окиснюються, розпадаються А. шляхом дезамінування (особливо інтенсивно йде в нирках і печінці) головним чином глутамінової кислоти, що утворилася шляхом переамінування, приводить до утворення кето- і оксікислот - проміжних продуктів циклу трикарбонових к-т. Далі вони перетворюються на вуглеводи, нові А. або окислюються до CO2 і H2O з виділенням енергії. При цьому азот у вигляді амонійних солей, сечовини і сечової кислоти виводиться з організму. У рослин зв'язаний нітроген використовується більш повно і азотисті відходи практично відсутні.
У тканинах живих організмів зустрічаються А. (біля. 100), що не входять до складу білків. Серед них важливі проміжні продукти обміну речовин (орнітин, цистатіонін і ін.), а також рідкісні А., біологічні функції яких нез’ясовані. У мікробіологічній промисловості використовують здатність мутантів штамів деяких мікроорганізмів продукувати різні А. (глутамінову к-ту, лізин і ін.). А., а також їх суміші, застосовують в медицині, тваринництві (для збагачення кормів), як початкові продукти для промислового синтезу поліамідів, фарбників. Багато А. одержані абіогенним шляхом в умовах що моделюють атмосферу первісної Землі (теорія Опаріна). АК є амфотерні сполуки – поєднують властивості кислот та лугів. Цим зумовлена їхня здатність до з’єднання. АК залишки у складі пептиду (ланцюга з АК) не мають одного атома водню в аміногрупі та атомів кисню і водню в карбоксильній групі, оскільки при утворенні пептичного зв’язку відщеплюється молекула води.
До складу білків входить 20 різних амінокислот. Амінокислоти характеризуються наявністю карбоксильної групи—СООН та аміногрупи—NH2. Молекули білків утворюють структури: первинну, вторинну, третинну, четвертинну.
Первинна структура білка—ланцюг залишків амінокислот.
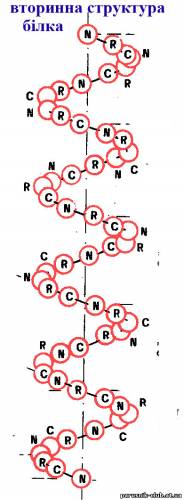
Вторинна структура білка—поліпептидний ланцюг залишків амінокислот, закручений в спіраль.
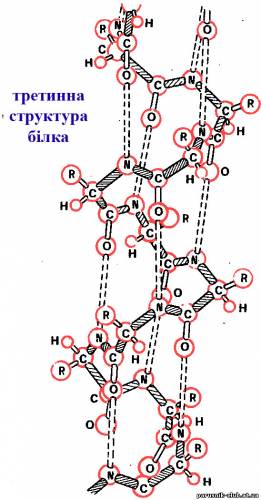
Третинна структура білка—спіраль поліпептидного ланцюга набуває просторову конфігурацію.
Четвертинна структура білка—остаточна просторова конфігурація білка, яка складається з декількох третинних структур. Поєднані вони між собою дисульфідними "мостиками" (див. рисунок). На рисунку зображені чотири конфігурації або їх ще називають конформації, поєднані за допомогою чотирьох "мостиків" (на рисунку у вигляді чотирьох овалів).
Білки складаються з амінокислот (АК). Поліпептиди – ланцюг до 50 АК. Вище ніж 50 АК – це повноцінний білок, розчинний у воді. Його молекулярна маса від 5000 до 50000. Білки з вмістом від 500 і вище АК – високомолекулярні напіврозчинні або зовсім не розчинні у воді.
Білки або протеїни, високомолекулярні органічні сполуки, відіграють першорядну роль в життєдіяльності всіх організмів, беруть участь в їх будові, розвитку і обміні речовин. Молекулярна м. Б. від ~ 5000 до багатьох мільйонів. Нескінченна різноманітність білкових молекул (у Б. входять, як правило, 20 L-амінокислот), обумовлене різною послідовністю амінокислотних залишків і завдовжки поліпептидного ланцюга, визначає відмінності їх просторової структури, хімічних і фізичних властивостей. Б володіють амфотерними властивостями і не проникають через напівпроникні мембрани. Єдиної класифікації Б. не існує. Залежно від форми білкової молекули розрізняють фібрілярні і глобулярні Б., від виконуваної ними функції - структурні, каталітичні (ферменти), транспортні (гемоглобін, церулоплазмін), регуляторні (деякі гормони), захисні (антитіла, токсини) і др.; від складу - прості Б. (протеїни, полягають тільки з амінокислот) і складні (протеїди, до складу яких разом з амінокислотами входять вуглеводи - глікопротеїди, ліпіди - ліпопротеїди, нуклеїнові кислоти - нуклеопротеїди, метали - металопротеїди і т. ін.); залежно від розчинності у воді, розчинах нейтральних солей лугах, кислотах і органічних розчинниках - альбуміни, глобуліни, глутеліни, гістони, протаміни, проламіни. Біол. активність Би. обумовлена їх незвичайно гнучкої, пластичної і в той же час строго впорядкованою структурою, що дозволяє вирішувати проблеми пізнавання на рівні молекул, а також здійснювати тонкі регулюючі дії. Розрізняють наступні рівні структурної організації Б.: первинну структуру (послідовність амінокислотних залишків в поліпептидному ланцюзі); вторинну (укладання поліпептидного ланцюга в
аспіральні ділянки і b-структурні утворення); третинну (тривимірну просторову упаковку поліпептидного ланцюга) і четвертинну (асоціацію декілька окремих поліпептидних ланцюгів в єдину структуру). Четвертинну структуру мають не всі Б.- найчастіше регуляторні. Іноді різні Б. утворюють надмолекулярні структури, що функціонують як єдине ціле. Найбільш стійка первинна структура Б., інші легко руйнуються при підвищенні температури, різкій зміні рН середовища і ін. діях. Таке порушення називається денатурацією і, як правило, супроводжується втратою біологічних властивостей. Первинна структура Б. визначає вторинну і третинну, тобто самозбірні структури білкової молекули. Така можливість показана на прикладі синтезу білка - ферменту рибонуклеази. Б. в клітинах організмів постійно оновлюються. Необхідність їх постійного оновлення лежить в основі обміну речовин. Вирішальна роль в біосинтезі Б. належить нуклеїновим к-там. Послідовність амінокислот в Б. відображає послідовність нуклеотидів в нуклеїнових кислотах (див. Генетичний код, Транскрипція, Трансляція). Тому Б.- найважливіші маркери для вивчення процесів еволюції і експресії генів. Б.- один з основних продуктів харчування людини і тварин. Недолік Б. у їжі приводить до ряду важких порушень азотистого обміну.
Ферменти це білки – каталізатори хімічних реакцій. Найбільш вивчена лейцинамінопептидаза, виділена в чистому вигляді з нирок і кришталика ока і що відщеплює переважно залишки амінокислот гідрофобного характеру; використовують при дослідженні первинної структури білків.
За типом реакцій, що каталізують, ферменти підрозділяються на 6 класів згідно з ієрархічною класифікацією ферментів (КФ або EC — Enzyme Commission code). Класифікацію було запропоновано Міжнародним союзом біохімії і молекулярної біології (International Union of Biochemistry and Molecular Biology). Кожен клас містить підкласи, так що фермент описується сукупністю чотирьох чисел, розділених крапками. Наприклад, пепсин має код КФ 3.4.23.1. Перше число описує клас реакцій, що каталізує фермент:
КФ 1: Оксидоредуктази — ферменти, що каталізують окислення або відновлення. Приклад: каталаза, алкогольдегідрогеназа
КФ 2: Трансферази — ферменти, що каталізують перенесення хімічних груп з однієї молекули субстрата на іншу. Серед трансфераз особливо виділяють кінази, що переносять фосфатну групу, як правило, з молекули АТФ.
КФ 3: Гідролази — ферменти, що каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеїнліпаза
КФ 4: Ліази — ферменти, що каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів.
КФ 5: Ізомерази — ферменти, що каталізують структурні або геометричні зміни в молекулі субстрата.
КФ 6: Лігази — ферменти, що каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ. Приклад: ДНК-полімераза
Будучи каталізаторами, ферменти прискорюють як пряму, так і зворотну реакції, тому, наприклад, ліази здатні каталізувати і зворотну реакцію — приєднання по подвійних зв'язках. Тим не менш напрямок реакції може залучати кілька субстратів і бути таким, що зворотна реакція практично не відбувається.
Структури білків: первинна, вторинна, третинна, четвертинна. Первинна структура утримується за допомогою пептидних зв'язків типу ковалентних зв'язків, що утворюються в процесі стадії трансляції біосинтезу білків. Ці пептидні зв'язки забезпечують жорсткість білка. Два кінці амінокислотного ланцюжка називаються C-кінцем або карбоксильним кінцем і N-кінцем або аміно-кінцем, закінчуються вільною групою на кожному кінці.
Різні види вторинної структури виникають локально між амінокислотами поліпептидного ланцюжка і стабілізуються водневими зв'язками. Проте, ці водневі зв'язки загалом недостатньо стійкі самостійно, тому що водневий зв'язок з молекулами води зазвичай сприятливіший, ніж водневий зв'язок між амідними групами. Тому вторинна структура стійка тільки коли локальна концентрація води достатньо низька, наприклад, в межах глобули або у повністю згорнутому білку.
Так само як і вторинна структура, утворення глобул і третинної структури стабілізується переважно структурно неспецифічними взаємодіями, наприклад спорідненістю амінокислот і гідрофобними взаємодіями. Проте, третинна структура стабілізується тільки коли деякі частини білка закріплені структурно специфічними взаємодіями, наприклад іонними зв'язками (солевими містками), водневими зв'язками і стерічною упаковкою бічних ланцюжків. Третинна структура позаклітинних білків може також стабілізуватися дисульфідними зв'язками, які скорочують ентропію розгорненого стану. Дисульфідні зв'язки надзвичайно рідкі в цитоплазматичних білках, тому що цитозоль зазвичай є відновлюючим оточенням.
Властивості білків: процес порушення структур білка до первинної – денатурація, можлива ретанурація.
Деструкція – порушення пептидних зв’язків білків.
Є білки гідрофобні та гідрофільні, прості (протеїни) та складні що містять сполуки іншої природи (протеїди).
Функції білків.
А. Будівельна
Б. цитоскелет клітини
В. колаген (хрящі)
Г. кератин
Д. захисна імунна (імуноглобуліни та інші білки імунної системи)
Є. білки крові для згортання (фібрин, тромбопластин, тромбін)
Ж. регуляторна (гормони, ферменти)
З. скорочувальна (актин, міозин).
І. запасаюча (у птах альбуміни)
К. гемоглобін
Л. нуклеопротеїди – залишки нуклеїнових кислот матеріальні носії спадкової інформації.
М. – транспортна (перенос сполук через мембрану клітини).
Н. енергетична – при розщепленні 1 г білків вивільнюється 17, 2 кДж енергії.
План.
1. Органічні речовини, їх різноманітність та значення в існуванні живих істот.
2. Білки – структурна основа біосистем.
3. Амінокислотний склад білків.
4. Будова та хімічні властивості амінокислот.
5. Рівні структурної організації білкової молекули.
6. Чинники підтримання та зміни конформації білка. Ф
7. Фізико-хімічні властивості білків.
8. Ферменти. Класифікація ферментів та її принципи. Структурно-функціональна організація ферментів.
9. Властивості ферментів.
Всі органічні сполуки на Землі поділяються на чотири основні групи: білки, ліпіди, вуглеводи і нуклеїнові кислоти. Ліпіди: ефіри жирних кислот і спиртів. Поділяють на дві великі групи: жири і ліпоїди.
Жири або гліцериди—складні ефіри трьохатомного спирту гліцерину та вищих жирних кислот.
Ліпоїди—жироподібні речовини (фосфатиди, стероїди, стеарини, воски.)
Вуглеводи: мають загальну хімічну формулу – (СН2О)n. Розрізняють три основні групи вуглеводів: полісахариди, дисахариди, моносахариди
Нуклеїнові кислоти: ДНК (дезоксирибонуклеїнова кислота), РНК (рибонуклеїнова кислота), АТФ, АДФ та АМФ, НАД (нікотинамідаденіндінуклеотид) та її похідні НАДФ, НАД+Н, НАДФ+Н.
Білки: високомолекулярні біополімери, мономерною одиницею яких є амінокислота.

У тканинах живих організмів зустрічаються А. (біля. 100), що не входять до складу білків. Серед них важливі проміжні продукти обміну речовин (орнітин, цистатіонін і ін.), а також рідкісні А., біологічні функції яких нез’ясовані. У мікробіологічній промисловості використовують здатність мутантів штамів деяких мікроорганізмів продукувати різні А. (глутамінову к-ту, лізин і ін.). А., а також їх суміші, застосовують в медицині, тваринництві (для збагачення кормів), як початкові продукти для промислового синтезу поліамідів, фарбників. Багато А. одержані абіогенним шляхом в умовах що моделюють атмосферу первісної Землі (теорія Опаріна). АК є амфотерні сполуки – поєднують властивості кислот та лугів. Цим зумовлена їхня здатність до з’єднання. АК залишки у складі пептиду (ланцюга з АК) не мають одного атома водню в аміногрупі та атомів кисню і водню в карбоксильній групі, оскільки при утворенні пептичного зв’язку відщеплюється молекула води.
До складу білків входить 20 різних амінокислот. Амінокислоти характеризуються наявністю карбоксильної групи—СООН та аміногрупи—NH2. Молекули білків утворюють структури: первинну, вторинну, третинну, четвертинну.
Первинна структура білка—ланцюг залишків амінокислот.
Вторинна структура білка—поліпептидний ланцюг залишків амінокислот, закручений в спіраль.
Третинна структура білка—спіраль поліпептидного ланцюга набуває просторову конфігурацію.
Четвертинна структура білка—остаточна просторова конфігурація білка, яка складається з декількох третинних структур. Поєднані вони між собою дисульфідними "мостиками" (див. рисунок). На рисунку зображені чотири конфігурації або їх ще називають конформації, поєднані за допомогою чотирьох "мостиків" (на рисунку у вигляді чотирьох овалів).
Білки складаються з амінокислот (АК). Поліпептиди – ланцюг до 50 АК. Вище ніж 50 АК – це повноцінний білок, розчинний у воді. Його молекулярна маса від 5000 до 50000. Білки з вмістом від 500 і вище АК – високомолекулярні напіврозчинні або зовсім не розчинні у воді.
Білки або протеїни, високомолекулярні органічні сполуки, відіграють першорядну роль в життєдіяльності всіх організмів, беруть участь в їх будові, розвитку і обміні речовин. Молекулярна м. Б. від ~ 5000 до багатьох мільйонів. Нескінченна різноманітність білкових молекул (у Б. входять, як правило, 20 L-амінокислот), обумовлене різною послідовністю амінокислотних залишків і завдовжки поліпептидного ланцюга, визначає відмінності їх просторової структури, хімічних і фізичних властивостей. Б володіють амфотерними властивостями і не проникають через напівпроникні мембрани. Єдиної класифікації Б. не існує. Залежно від форми білкової молекули розрізняють фібрілярні і глобулярні Б., від виконуваної ними функції - структурні, каталітичні (ферменти), транспортні (гемоглобін, церулоплазмін), регуляторні (деякі гормони), захисні (антитіла, токсини) і др.; від складу - прості Б. (протеїни, полягають тільки з амінокислот) і складні (протеїди, до складу яких разом з амінокислотами входять вуглеводи - глікопротеїди, ліпіди - ліпопротеїди, нуклеїнові кислоти - нуклеопротеїди, метали - металопротеїди і т. ін.); залежно від розчинності у воді, розчинах нейтральних солей лугах, кислотах і органічних розчинниках - альбуміни, глобуліни, глутеліни, гістони, протаміни, проламіни. Біол. активність Би. обумовлена їх незвичайно гнучкої, пластичної і в той же час строго впорядкованою структурою, що дозволяє вирішувати проблеми пізнавання на рівні молекул, а також здійснювати тонкі регулюючі дії. Розрізняють наступні рівні структурної організації Б.: первинну структуру (послідовність амінокислотних залишків в поліпептидному ланцюзі); вторинну (укладання поліпептидного ланцюга в
аспіральні ділянки і b-структурні утворення); третинну (тривимірну просторову упаковку поліпептидного ланцюга) і четвертинну (асоціацію декілька окремих поліпептидних ланцюгів в єдину структуру). Четвертинну структуру мають не всі Б.- найчастіше регуляторні. Іноді різні Б. утворюють надмолекулярні структури, що функціонують як єдине ціле. Найбільш стійка первинна структура Б., інші легко руйнуються при підвищенні температури, різкій зміні рН середовища і ін. діях. Таке порушення називається денатурацією і, як правило, супроводжується втратою біологічних властивостей. Первинна структура Б. визначає вторинну і третинну, тобто самозбірні структури білкової молекули. Така можливість показана на прикладі синтезу білка - ферменту рибонуклеази. Б. в клітинах організмів постійно оновлюються. Необхідність їх постійного оновлення лежить в основі обміну речовин. Вирішальна роль в біосинтезі Б. належить нуклеїновим к-там. Послідовність амінокислот в Б. відображає послідовність нуклеотидів в нуклеїнових кислотах (див. Генетичний код, Транскрипція, Трансляція). Тому Б.- найважливіші маркери для вивчення процесів еволюції і експресії генів. Б.- один з основних продуктів харчування людини і тварин. Недолік Б. у їжі приводить до ряду важких порушень азотистого обміну.
Ферменти це білки – каталізатори хімічних реакцій. Найбільш вивчена лейцинамінопептидаза, виділена в чистому вигляді з нирок і кришталика ока і що відщеплює переважно залишки амінокислот гідрофобного характеру; використовують при дослідженні первинної структури білків.
За типом реакцій, що каталізують, ферменти підрозділяються на 6 класів згідно з ієрархічною класифікацією ферментів (КФ або EC — Enzyme Commission code). Класифікацію було запропоновано Міжнародним союзом біохімії і молекулярної біології (International Union of Biochemistry and Molecular Biology). Кожен клас містить підкласи, так що фермент описується сукупністю чотирьох чисел, розділених крапками. Наприклад, пепсин має код КФ 3.4.23.1. Перше число описує клас реакцій, що каталізує фермент:
КФ 1: Оксидоредуктази — ферменти, що каталізують окислення або відновлення. Приклад: каталаза, алкогольдегідрогеназа
КФ 2: Трансферази — ферменти, що каталізують перенесення хімічних груп з однієї молекули субстрата на іншу. Серед трансфераз особливо виділяють кінази, що переносять фосфатну групу, як правило, з молекули АТФ.
КФ 3: Гідролази — ферменти, що каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеїнліпаза
КФ 4: Ліази — ферменти, що каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів.
КФ 5: Ізомерази — ферменти, що каталізують структурні або геометричні зміни в молекулі субстрата.
КФ 6: Лігази — ферменти, що каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ. Приклад: ДНК-полімераза
Будучи каталізаторами, ферменти прискорюють як пряму, так і зворотну реакції, тому, наприклад, ліази здатні каталізувати і зворотну реакцію — приєднання по подвійних зв'язках. Тим не менш напрямок реакції може залучати кілька субстратів і бути таким, що зворотна реакція практично не відбувається.
Структури білків: первинна, вторинна, третинна, четвертинна. Первинна структура утримується за допомогою пептидних зв'язків типу ковалентних зв'язків, що утворюються в процесі стадії трансляції біосинтезу білків. Ці пептидні зв'язки забезпечують жорсткість білка. Два кінці амінокислотного ланцюжка називаються C-кінцем або карбоксильним кінцем і N-кінцем або аміно-кінцем, закінчуються вільною групою на кожному кінці.
Різні види вторинної структури виникають локально між амінокислотами поліпептидного ланцюжка і стабілізуються водневими зв'язками. Проте, ці водневі зв'язки загалом недостатньо стійкі самостійно, тому що водневий зв'язок з молекулами води зазвичай сприятливіший, ніж водневий зв'язок між амідними групами. Тому вторинна структура стійка тільки коли локальна концентрація води достатньо низька, наприклад, в межах глобули або у повністю згорнутому білку.
Так само як і вторинна структура, утворення глобул і третинної структури стабілізується переважно структурно неспецифічними взаємодіями, наприклад спорідненістю амінокислот і гідрофобними взаємодіями. Проте, третинна структура стабілізується тільки коли деякі частини білка закріплені структурно специфічними взаємодіями, наприклад іонними зв'язками (солевими містками), водневими зв'язками і стерічною упаковкою бічних ланцюжків. Третинна структура позаклітинних білків може також стабілізуватися дисульфідними зв'язками, які скорочують ентропію розгорненого стану. Дисульфідні зв'язки надзвичайно рідкі в цитоплазматичних білках, тому що цитозоль зазвичай є відновлюючим оточенням.
Властивості білків: процес порушення структур білка до первинної – денатурація, можлива ретанурація.
Деструкція – порушення пептидних зв’язків білків.
Є білки гідрофобні та гідрофільні, прості (протеїни) та складні що містять сполуки іншої природи (протеїди).
Функції білків.
А. Будівельна
Б. цитоскелет клітини
В. колаген (хрящі)
Г. кератин
Д. захисна імунна (імуноглобуліни та інші білки імунної системи)
Є. білки крові для згортання (фібрин, тромбопластин, тромбін)
Ж. регуляторна (гормони, ферменти)
З. скорочувальна (актин, міозин).
І. запасаюча (у птах альбуміни)
К. гемоглобін
Л. нуклеопротеїди – залишки нуклеїнових кислот матеріальні носії спадкової інформації.
М. – транспортна (перенос сполук через мембрану клітини).
Н. енергетична – при розщепленні 1 г білків вивільнюється 17, 2 кДж енергії.